Глаз не алмаз, а полупроводник - «Здоровье»

Все темы сайта разделены на несколько каталогов для всей семьи: В каталоге "Лучшая мама" - собраны статьи для и о прекрасных женщинах, лучших мамах. Он включает статьи о зачатии, беременности, родах, как оставаться всегда в самой лучшей форме, и быть здоровой, самой красивой, гостеприимной хозяйкой - мастерицей.
Ученые разработали имплант сетчатки глаза, с помощью которого им уже удалось вернуть зрение крысам. Изобретатели планируют перейти к испытаниям на людях уже в этом году.
Имплант, который преобразует свет в электрические сигналы, стимулирующие нейроны сетчатки, даст надежду миллионам людей, страдающих от дегенерации сетчатки, включая пигментный ретинит, при котором нарушается работа фоторецепторов, что приводит к слепоте.
Сетчатка – это внутренняя оболочка глаза. В ней содержатся миллионы фоторецепторов, необходимых для зрения. Однако мутация даже в одном из 240 связанных с формированием сетчатки генов может привести к дегенерации сетчатки, при которой светочувствительные клетки отмирают, а нейроны сетчатки при этом продолжают функционировать.
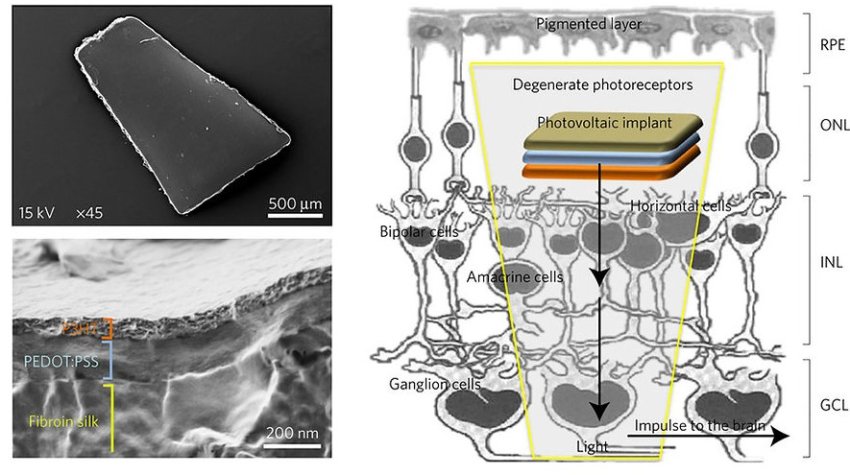
Команда специалистов из Итальянского института технологий смогла разработать протез сетчатки, который берет на себя ее функции.
Имплант состоит из тонкого слоя электропроводящего полимера, расположенного на основанном на шелке субстрате, и внешнего покрытия из полупроводящего полимера. О результатах работы ученые рассказали в журнале Nature Materials.
Полупроводящий полимер действует как фотоэлектрический материал, поглощая фотоны, когда свет попадает на хрусталик — биологическую линзу, преломляющую свет. Когда это происходит, электричество стимулирует нейроны сетчатки, заполняя пространство между поврежденными фоторецепторами.
Чтобы проверить новинку, ученые имплантировали искусственную сетчатку крысам из специально выведенной линии с дегенерацией сетчатки. Спустя 30 дней после операции исследователи протестировали их восприимчивость к свету по сравнению со здоровыми крысами и крысами той же генетической линии, не получивших лечения.
В норме при попадании в глаза яркого света зрачок сужается, в темноте – расширяется. Это называется зрачковым рефлексом. При яркости света в один люкс – чуть ярче, чем при полнолунии – у крыс с искусственной сетчаткой не было выявлено значимых отличий от больных. А вот при 4-5 лк – примерно как во время сумерек – зрачки крыс с имплантом реагировали почти так же, как зрачки здоровых мышей.
Имплант эффективно работал и спустя 10 месяцев после операции, хотя у всех трех групп крыс зрение несколько ухудшилось из-за возрастных изменений.
Также с помощью позитронно-эмиссионной томографии ученые проверили активность мозга крыс во время тестов на чувствительность к свету и обнаружили рост активности в зрительной коре, отвечающей за обработку визуальной информации.
Основываясь на полученных результатах, команда заключила, что имплант напрямую активирует «остаточные нейронные схемы в дегенеративной сетчатке». Необходимы дальнейшие исследования, чтобы подробно описать этот процесс с точки зрения биологии.
«Детализированный принцип работы протеза остается неопределенным», — отмечают они в статье. Кроме того, неизвестно, будут ли такие импланты так же эффективны для людей. Но команда полна оптимизма и рассчитывает проверить это уже в ближайшее время.
«Мы надеемся воспроизвести на людях такие же прекрасные результаты, какие получили при эксперименте с животными, — говорит одна из исследователей, офтальмолог Грация Пертиле.
— Мы планируем первые тесты на людях во второй половине этого года, а к 2018-му получим предварительные результаты. Использование этого импланта может стать поворотной точкой в лечении тяжелых заболеваний сетчатки».
Другой перспективный метод лечения таких болезней — редактирование генома с помощью технологии CRISPR. Это удалось сделать в прошлом году группе офтальмологов из США. Они использовали клетки кожи пациента с пигментным ретинитом, чтобы вырастить стволовые клетки, которые тоже несли в себе приводящую к слепоте мутацию. CRISPR позволила успешно «отремонтировать» дефектный ген. На момент проведения исследования эксперименты на людях были запрещены, но, как утверждают сами исследователи, трансплантация здоровых клеток могла бы восстановить утраченное зрение.
В отличие от традиционной пересадки органов, такой подход не вызовет отторжения иммунной системой.
А пересадка глаза полностью не осуществляется вообще из-за его высокой степени антигенности и сложной сосудистой системы. Успешны могут быть лишь операции по пересадке части глаза, например, роговицы.
А в Австралии в то же время ученые были готовы к испытаниям бионического глаза. Глаз Phoenix99 был разработан инженерами из Университета Нового Южного Уэльса. Его создание началось еще в 1997 году с целью помочь людям с пигментным ретинитом и макулодистрофией – патологическим изменением сосудов глаза, характерным для пожилых людей.
Прототип глаза представлял собой массив из 24 электродов, подсоединенных к внешнему устройству и позволяющих пациенту видеть фосфены – светящиеся точки и фигуры, возникающие без воздействия света, например при надавливании на глаз или электрическом возбуждении сетчатки.
С помощью специальных камер было также можно определять расстояние – чем ярче были фосфены, тем ближе находился объект.
Последняя модель Phoenix99 имплантируется полностью и показывает значительно лучшие результаты, чем предыдущие. К 2018 году исследователи планируют вживить бионические глаза по меньшей мере десяти пациентам. Операция занимает 2-3 часа и единственное, что указывает на неестественную природу новых глаз – небольшой диск за ухом, который питает устройство и передает на него данные.
Смотрите также: